再生医療と再生医療等委員会について よくある質問Q&A
ご質問1
1人の開業医が所属している複数の医院で同一の再生医療をする場合、提供計画の審査を1回で済ますことは可能でしょうか。
また、上記の場合、定期報告も1回で済ませますでしょうか。
(費用も併せてお教えください。)
回答1
同じ治療であっても、医院が異なることにより、施設の構造設備や人的力量、人員の配置等、異なる点があるため、1回にまとめて審査をすることはできません。(審査ごとに費用がかかります。)
しかし、定期報告については、再生医療等提供計画の内容や報告の内容、審査開催時期の調整などにより、複数の審査を同日(同時)に実施することは可能と考えられ、その際は弊社の規定において、都度見積もりをすることはできます。
ご質問2
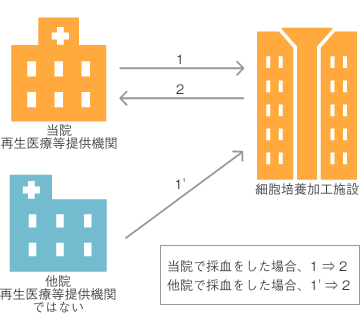
当院では、採血から再生医療等までの流れを以下の2通りで考えています。
- [当院で採血]→[細胞培養加工施設で加工]→[当院で再生医療等の提供](下図の1→2)
- [他院で採血]→[細胞培養加工施設で加工]→[当院で再生医療等の提供](下図の1’→2)
この場合、採血をする医院が複数になりますが、1つの再生医療等提供計画で申請できますか。
回答2
地方厚生局に確認したところ、あらかじめ両方のフローについてしっかり記載していれば、1つの再生医療等提供計画で申請できるとの回答をいただきました。
ただし、例えば以下のような点には十分配慮してください。
- 血液を取り違えないような仕組みを作ること
- 違う医院で採血しても品質が一定に保たれること
- 輸送によるリスクを軽減させていること
- 場所が異なることで患者様が混乱しないようにすること
- 1’のフローで問題が発生した場合でも再生医療等提供機関が責任をとる体制であること
また、当委員会で審査を行った場合であっても、厚生局で判断の結果、安全性・有効性に対して疑義があると判断した場合には、厚生局から追加で資料を求められたり、場合によっては再生医療等が提供できないことも想定されるとのことでした。
ご質問3
特定細胞加工物製造状況の定期報告のやりかたが分かりません。
また、この定期報告で使用する「特定細胞加工物製造状況定期報告書」の書き方も知りたいです。
回答3
各種申請書作成支援サイト から作れます。
「特定細胞加工物製造届」の受理日から1年ごとに各地方厚生局へ定期報告が必要です。提出期限は、1年の満期を迎えてから60日以内です。
(例えば、受理日が2015年5月24日の場合、集計期間は2015年5月24日から2016年5月23日の1年間で、報告期限は2016年7月23日になります。)
ただし、初年度に限っては、再生医療等提供計画受理前に製造した分は、定期報告から除外して差支えありません。
(例えば、製造届の受理日が2015年5月24日で、提供計画の受理日が2015年11月24日の場合、製造状況の集計期間は、2016年11月24日から2016年5月23日となります。)
上記の日付の管理に使える『定期報告カレンダー』を厚生局が公開しているので、参考にしてみてください。
・中国四国厚生局
・東北厚生局
「特定細胞加工物製造状況定期報告書」の記載例については、以下リンク先を参照ください。
・表面の記載例
・裏面の記載例
特定細胞加工物が複数ある場合、入力画面で”製造状況を追加する”ボタンを押して入力枠を増やしてください。
・”製造状況を追加する”ボタン


